- インタビュー
- 「きぼう」利用
タンパク質の「構造」が紐解く生物発光 基礎の探究が社会への応用につながる
独立行政法人産業技術総合研究所 関西センター バイオメディカル研究部門 副研究部門長 三谷恭雄

夏の夜の水辺をほのかに彩るホタルや、夜の海辺にきらめく夜光虫、さらには海に漂うクラゲなど、自ら光を発する生物は意外に多く存在します。
こうした「生物発光」は、古くは古代ギリシア時代から探究の対象となってきました。現在ではホタルなどほんの一部については、どのようなメカニズムで発光するのか、生体レベル、分子レベルで分かってきているものの、大部分ではその詳細な発光メカニズムは不明で、またなぜ生物がこのような仕組みを獲得したのかも分かっていません。
これらの謎を解明する切り口の一つが、生物発光を担う重要な物質であるタンパク質です。宇宙実験を通してタンパク質の「構造」を解き明かし、生物発光の仕組みを医学領域へ応用する道を拓いた、産業技術総合研究所の近江谷克裕先生、三谷恭雄先生にお話を伺いました。
生物発光に魅せられて30年あまり、フィールドでの探索から医学への応用まで幅広く研究
Q:近江谷先生は生物発光にかかわるタンパク質の研究を30年以上続けています。この分野に関心をもたれたきっかけは何ですか。
近江谷:私は30歳くらいのときにこの研究を始めましたが、純粋に生物発光が綺麗だと思ったことが最初の興味でした。 また、私が研究を始めた頃はこの領域の基礎研究をしている人は非常に少なく、誰も取り組んでいないテーマを研究するというやりがいもありそうだと感じたのです。加えて、ライバルがいない気楽な世界かなと思ったところもあります。
いざ入ってみると生物発光の世界は奥が深く、生物学、生化学、物理学、医学などさまざまな学問分野にまたがった研究が必要です。私自身は発光生物の採集から発光のもととなる物質の探索、その応用まで研究をしています。
ちなみに、ルシフェリンはホタルのものが最初に見つかり、次にウミホタルのものが見つかりました。このウミホタル研究の第一人者が下村脩先生で、世界で最初にウミホタルルシフェリンの結晶化に成功しています。下村先生はその後、アメリカに渡り、オワンクラゲという別の海洋発光生物の研究を進める中で、緑色蛍光タンパク質(green fluorescent protein:GFP)を発見し、後のノーベル化学賞受賞につながります。しかし、ウミホタルの発光研究に関しては、その後なかなか進展が見られなかったという経緯があり、私たちは日本の研究者としてこれを解き明かしたいと思って挑戦を続けています。

Q:基礎から応用まで、幅広く研究を進めているのですね。三谷先生はなぜ生物発光の研究に取り組むことになったのですか。
三谷:私は大学院生のとき、発生生物学という生き物が卵からどのように形づくられていくかを研究する分野を専攻していました。その後、産総研に入って近江谷さんと知り合い、足掛け15年ほど、一緒に研究させていただいています。
近江谷さんは生物発光の領域では有名人で、かつ、面白おかしく話をしてくれるので、興味を惹かれたんです。
今でもよく覚えていますが、初顔合わせでいきなり「来月ノルウェーに行こう」と言われて、フィヨルドの近く、水深200〜300メートルの深海に生息する、光るサメを捕獲しに行ったことがありました。これが発光生物を相手にした最初の経験でしたが、以来、本格的に研究を始め、今に至っています。

体内で「燃える」酸素が光のもと 生物発光のふしぎな仕組み
Q:深海生物などは光るものが多いイメージがありますが、こうした生き物はなぜ光るのでしょうか。
近江谷:先日、あるテレビ番組で同じ質問に答えましたが、そのときには「酸素が毒だから」と話しました。酸素は、多くの生物にとって生きるために必須の物質ですが、一部の酸素は反応性の高い危険な活性酸素に変化します。聞いたことがあるかもしれませんが、活性酸素は、バクテリアやがん細胞を除去する役割をもっている一方で正常な細胞などにもダメージを与えてしまいます。この活性酸素を取り除くために生物が光りはじめたと考えられています。つまり、発光は危険なものを除去するスカベンジャー(scavenger)の役割を担っています。
Q:有害な酸素を除去しようとする体の働きの一環で、光るようになったということですか。
近江谷:そうです。でも、光ること自体も繁殖や敵からの逃避など、生物の生存戦略の中で有利に働きます。もともとの理由は酸素の除去ですが、光が便利だからより強く光るように進化していったのだと私たちは考えています。
発光の基になる物質をルシフェリン、発光を触媒する物質、タンパク質をルシフェラーゼと呼びますが、基質がどのような(前駆)物質からできているかは生物によって異なります。つまり、ルシフェリンやルシフェラーゼにはたくさんの種類があるのです。
Q:ルシフェリン、ルシフェラーゼによって発光が起こる仕組みを教えてください。
近江谷:私たちが研究で用いたウミホタルは、3つのアミノ酸が化学反応してできた基質ルシフェリンをもっており、ルシフェリンが酸素と結びついて燃える(酸化反応)ことで酸素をスカベンジ(除去)します。この酸化反応が発光の正体です。
実は、全ての基質は酸化反応の際にごくわずか光るのですが、酵素であるルシフェラーゼが加わることで光が強くなったり色が変わったりします。さまざまな生物がこれを利用して自らの生存戦略に使っているところが、生物発光の面白さです。
三谷:一方、進化の過程でルシフェリンとルシフェラーゼを同時に獲得するということは考えづらいのです。つまり、ルシフェリンかルシフェラーゼそれぞれの基となるような物質を先にもっていて、それをスカベンジャーとして使っていた。進化の過程を経て、発光のための特異的なルシフェリンあるいはルシフェラーゼを獲得したと考えられます。
これまでに見てきた発光生物では、発現している遺伝子を解析すると、発現量の上位5番目くらいにルシフェラーゼの遺伝子が出てきます。発光タンパク質が外敵からの回避や繁殖行動といった生死にかかわる重要な役割をもつようになったからだと言えます。

ウミホタルの発光の様子とウミホタルの拡大図。大きいものでおよそ3 mm程度(右)。
(Image by 産業技術総合研究所(三谷恭雄氏による撮影・作成))
発光の仕組みを探るため、宇宙でタンパク質結晶を生成 その成果は医学にも応用
Q:生き物の生存戦略にも重要な役割をもつ発光タンパク質ですが、なぜ宇宙実験でその結晶を生成しようと思われたのですか。
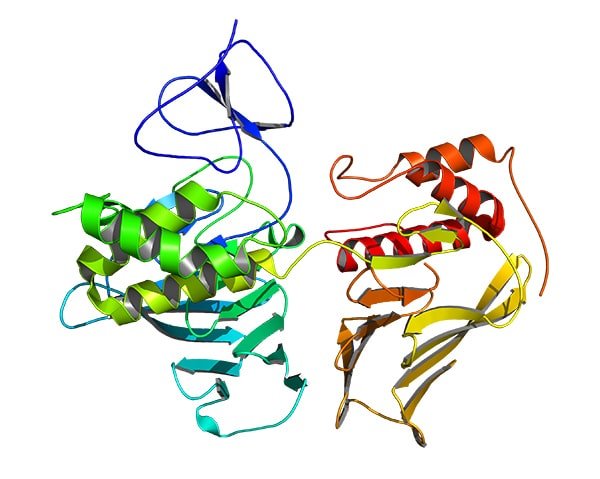
近江谷:ホタルなどの発光タンパク質ルシフェラーゼの結晶構造はすでに明らかになっていたのですが、ウミホタルのルシフェラーゼ(CLuc、シールック)については構造が明らかになっていませんでした。ウミホタルルシフェラーゼを結晶化させることが難しかったので、長い間、私たちは対流が起きない宇宙の微小重力環境下で質のよい結晶をつくることで構造を明らかにしたいと考えてきました。
これは、CLucには糖鎖という物質が不均一に付いているため、結晶を作ることが難しいという課題があり、糖鎖が付かないようにする操作などが必要でした。そのほかにもいくつも課題があって、JAXAと共同研究を始めたもののなかなか結晶はできず、初めて結晶が得られたのは共同研究開始から4年ほど経った頃です。それでも地上で得られる結晶は品質があまり良くなく、構造解析には至らなかったのですが、さまざまな条件検討を行ったうえで宇宙での結晶化を試みたところ、これまでにない品質の良い結晶が得られ、ついにCLucの構造を決定することができました。

Q:先生方は宇宙実験を複数回、実施されました。詳細な結晶構造や発光の仕組みが分かったことで医学への応用につながったそうですね。
近江谷:ウイルスなどが体内に侵入したり、がん細胞ができたりすると、その異物(抗原)に抗体が付きます。この抗体が光れば、そこに抗原があると分かるので、病気の診断に役立ちます。
ホタルなどがもっているルシフェラーゼは室温でどんどん壊れてしまいますが、CLucは海中で吐き出されるという性質上、とても丈夫です。そのため、抗体に付けても活性が落ちません。これを利用して、ウイルスやがんを高感度に見つけることができます。
CLucの構造が解析できたことは、発光生物学において大きな成果です。
産総研ではウミホタルルシフェリンが新型コロナウイルスのスパイクタンパク質と反応することを発見し、ウイルス検出の新手法の一つとして期待できることを明らかにしました。タンパク質の精密な構造を明らかにすることには社会にとっても大きなインパクトがあると分かっていただけると思います。
三谷:先ほど、ルシフェリンとルシフェラーゼは発光生物によって異なるとお話ししましたが、個々の分子構造の違いが機能の違いにつながっているので、そのメカニズムが分かれば、我々が求める性質に改変する足がかりにもなると考えています。
地道な取り組みが未知の構造を解き明かす 難敵に立ち向かうパッションを共有
Q:宇宙実験の経験から得られた気づきは何ですか。
近江谷:現在では、コンピューター上でタンパク質の結晶構造を予測するプログラムがあります。これが出てきたとき、「今まで一生懸命やってきたけど、これで構造が解けてしまったら嫌だよね」と言っていたのですが、結局、予測された構造だけからでは、我々が求める情報は得られませんでした。私たちが相手にしていたCLucは、すでに知られているどんなタンパク質構造とも似ていなかったので、それが予測を困難にしたのかもしれません。
宇宙で質の高い結晶を作らない限り、構造は解明できなかった。宇宙空間で結晶構造を探る作業は、まだ終わらないと思います。
構造が解けたことで、行き当たりばったりのサイエンスだったものが、理屈が通ったサイエンスに変わります。宇宙のおかげでよい結晶ができ、詳細な構造が分かったからこそ次に進める。私としては、そこが一番よかったと思います。
Q:宇宙実験の実施に向けたご苦労などはありましたか。
近江谷:私たちの共同研究は、宇宙実験のみならずその準備段階であるタンパク質の高純度精製や結晶化条件の検討作業もJAXAの方々に実施いただけたので、産総研グループとしては自分たちの専門とする実験のための作業に集中することができました。
特に共同研究の初期段階で実施した糖鎖の処理の部分や、タンパク質試料の大量調製法の部分ですね。構造解析に成功した現在では、共同研究チームに新たに基質ルシフェリンの合成やタンパク質化学を専門とするメンバーにも入ってもらい、得られた構造情報から、どのように新しい研究や応用につなげていくか、ということを考える新しいフェーズに入っています。
三谷:いろいろ試しましたね。通常、タンパク質を作るには大腸菌を利用しますが、ウミホタルの発光タンパク質はそれでは作れない。紆余曲折を経て、最終的に動物の細胞を分離した培養細胞の中で作ることができました。近江谷さんが言った糖鎖修飾の解除など、一つひとつ確認して、次のステップに進んでいきました。
近江谷:難敵でしたね。
大変でしたが、JAXAと並走しながらやれたから、ここまで来ることができたと思います。片方だけにパッションがあるのではなく、互いに、「なかなか攻略できない難敵だから一緒に頑張ろう」という思いが一致していました。
三谷:ターゲットに関する周辺情報が何も分かってないだけに、一つ分かったつもりになると、また分からないことが出てくる。結晶が読み解けてきていろいろな想像が膨らむようになりましたが、するともっと分からないことが出てきます。それを科学的に証明するにはどういう実験系を組んだらいいのか、そういうところにまた戻ってきている感じですね。
宇宙は、地上での研究を別の角度から眺めることができるフィールド
Q:発光タンパク質研究の展望、今後の研究のご予定をお聞かせください。
近江谷:CLucは私の基礎、応用研究におけるライフワークの一つです。今、ようやく構造が解けてきて、先ほど紹介した新型コロナウイルスの検出や、がんの診断に展開されるようになりました。
発光タンパク質の主な応用は、「見えないものを見つける」ことだと思っています。未知のウイルスなど、これからも「見つけたいもの」は新たに現れるはずです。そういうときに、この構造情報が大きく役立つと思っています。個人的には、今後は海外に拠点を移して生物発光の研究を続けていきたいと考えています。
三谷:ホタルのルシフェリンもウミホタルのルシフェリンも人工的に合成できます。ところが、これを生物がどうやって作っているかは分かっていません。
一つのヒントは、ルシフェリンを作る遺伝子です。遺伝子を見ることで、生物がルシフェリンを作るための遺伝子を獲得した経緯が分かるかもしれないと考えています。ルシフェリン、ルシフェラーゼの獲得経緯が分かれば、生物がある機能を獲得する仕組みも判明するかもしれないので、この点は今後アプローチしていきたいと思っています。
Q:最後に、「きぼう」利用に関心をもつ研究者の方に向けて、メッセージをお願いします。
近江谷:分からないことを自分の中に止めるのではなく、オープンに発信してほしいと思います。それを受け止める方々がどこかにいると思うし、そうした人々がうまく連携して伴走できるような研究者社会であってほしいと思います。
そういう意味で、構造というものの重要性を認識しなければいけません。目先の応用だけでなく、その先まで長い目で見たときには、基礎的な構造を正確に知っていることが重要です。宇宙はその答えを出してくれる場所だということを、もっと皆さんに知っていただきたいと思います。
三谷:宇宙実験を通した結晶構造の解明は非常にインパクトのある成果です。
私は、この実験の話をいろいろな人にしますが、自分の研究を宇宙でやるとどうなるのかと皆さん非常に興味をもたれます。
多くの研究者は、宇宙実験の可能性や、自分の研究が宇宙とつながり得ることにイメージがありませんが、「当たり前」が別の角度で見えてくることがたくさんあるのではないかと思います。宇宙は、全てのことが新しいことにつながっていく、非常に大きなチャンスを秘めたフィールドだと感じています。
プロフィール

独立行政法人産業技術総合研究所 関西センター バイオメディカル研究部門 首席研究員
1990年群馬大学大学院医学研究科修了。医学博士。静岡大学教育学部 助教授、産業技術総合研究所 グループ長、北海道大学医学研究科 先端医学講座光生物学分野 教授等を経て現職。30年以上にわたって生物発光の基礎、応用研究に取り組み、生体に優しい「生物発光」を生体イメージング、病理診断の可視化技術の実現に向けた理論を探究。また、生物発光の生物学、物理学、化学に関する基礎知識の発信にも積極的に取り組んでいる。
独立行政法人産業技術総合研究所 関西センター バイオメディカル研究部門 副研究部門長
独立行政法人産業技術総合研究所 生物機能工学研究部門 主任研究員、同 生物プロセス研究部門 主任研究員、同 生命工学領域 研究グループ長等を経て現職。ルシフェラーゼやルシフェリンを対象に、新規発光生物の探索から、その発光分子機構解明、発光機能の進化について研究進める傍ら、これらの発光を担う分子を利用した各種検出技術開発に向けた研究も実施している。
※特に断りのない限り、画像クレジットは©JAXA



