詳細
研究代表者 研究分担者
上村 大輔(北海道大学遺伝子病制御研究所)
田中 勇希(北海道大学遺伝子病制御研究所)
要旨
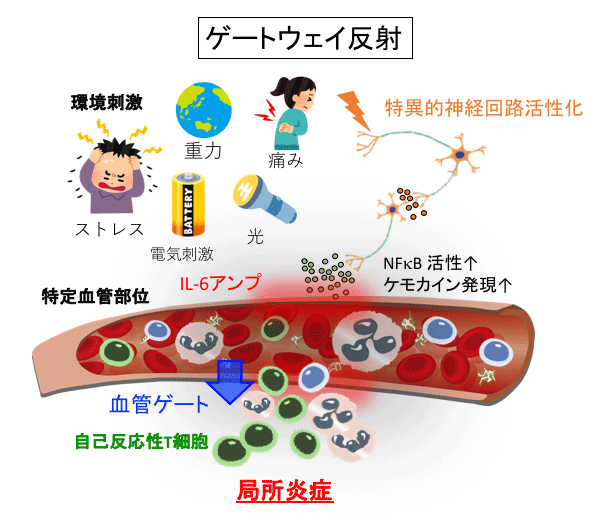
我々は、様々な環境刺激(この場合は地球の重力)に対する特異的な神経刺激が、局所血管の性質を変化させて局所炎症を調節する現象である"ゲートウェイ反射"を2012年に発見しました。重力によるゲートウェイ反射は、ヒラメ筋を刺激して第5腰髄の背側血管に免疫細胞の入り口を形成させ、局所炎症を起こりやすくしています。本研究では、この重力ゲートウェイ反射が微小重力下ではどのように作用するのか炎症モデルマウスを使って検証します。
2019年5月に実施した第4回小動物飼育ミッションでの長期飼育では、中枢神経系と網膜を認識する2種の自己反応性T細胞を移入したマウス6匹を国際宇宙ステーション(ISS)・「きぼう」日本実験棟の微小重力環境下で32日間飼育し、6匹全頭を地上に生存帰還することができました。これらのマウスの解析を現在実施中です。この研究の成果は、重力刺激を介する局所神経の活性化の炎症応答への重要性の証明に繋がり、宇宙飛行士はもとより、地上においても様々な病気に関連する炎症性疾患において、神経刺激を介した新しい制御法を開発できると考えられます。
実験の概要
中枢神経系である脳や脊髄の血管は、細胞、生体高分子や病原体の出入りを『血液脳関門』と言う特殊な構造で制限しています。しかし、中枢神経系にも細菌やウイルスが感染したり、がん転移が生じたり、さらに自己反応性の免疫細胞が侵入して生じる難病も発症します。こうした背景から、病原体や免疫細胞などが中枢神経系に入りやすい侵入口(ゲート)がある可能性が考えられてきました。しかし、そのゲートがどこにあり、またどのように形成されるのかなど、実体は不明でした。我々は、2012年に中枢神経系の慢性炎症疾患である多発性硬化症のマウスモデル(実験的自己免疫性脳脊髄炎、EAE)を用いて、血液脳関門の免疫細胞のゲート部位とその形成機構を調べ、第5腰髄(L5)の背側血管がそのゲートであることを世界で初めて突き止めました(Cell 2012)。さらに、ゲートウェイ反射が作用するためには、IL-6アンプ(Immunity 2008、2019、Cell Rep 2013、JI 2015、2016、2018(1)、2018(2)、JID 2019、A&R 2020、II2017、2020など)という炎症誘導のための分子機構が必要であることを発見しました。IL-6アンプは、非免疫細胞において転写因子NF-κBとSTAT3が同時活性化することによってNF-κB活性が相乗的に増強する分子機構であり、このIL-6アンプによって自己反応性を含む免疫細胞を呼び寄せる作用をもつケモカインなどの炎症性分子の発現が局所で増大し、その部位に炎症が誘導されます。神経刺激によって放出される神経伝達物質はIL-6アンプの活性化をより増強するので、神経伝達物質が作用した特定部位の血管が炎症を起こしやすくなり、ゲートウェイ反射が媒介されます。
図1
図2
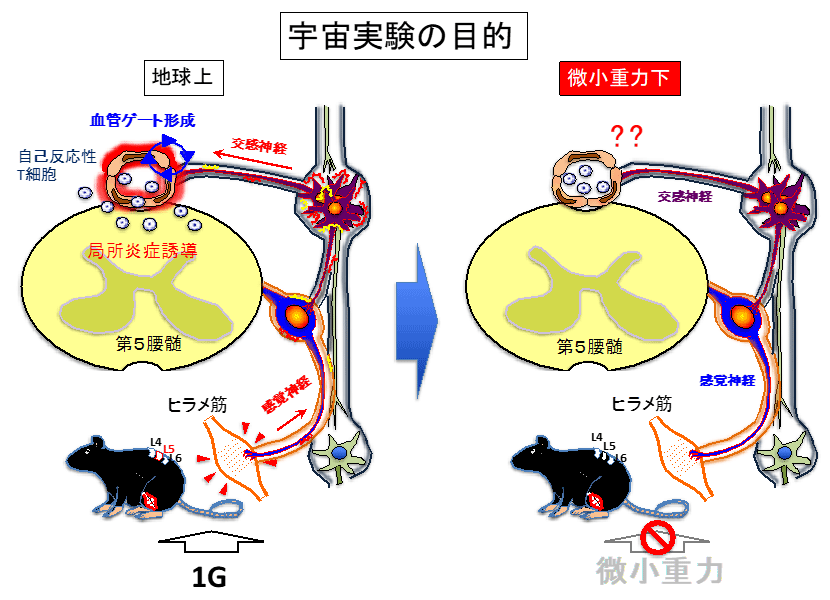
重力ゲートウェイ反射では、地球の重力による日常的な刺激が、ふくらはぎのヒラメ筋を介してL5に繋がる神経を活性化させ、それがL5血管に慢性炎症の誘導機構であるIL-6アンプを刺激して、転写因子NF-κBが過剰活性化し、その血管選択的に自己反応性を含む免疫細胞を引き寄せるゲートが形成されることを地上での実験によって明らかにしました。このような、ある環境刺激(この場合は地球の重力)に対する特異的な神経刺激が、局所血管の性質を変化させて炎症を調節する現象は、現在、"ゲートウェイ反射"として知られています。これまでに我々は、重力の他に、電気刺激、痛み、慢性ストレスと光によるゲートウェイ反射を報告しています(Cell 2012、eLife 2015、2017、Sci Rep 2019)(図1)。
重力刺激を介するヒラメ筋(ふくらはぎにある筋肉)の刺激から生じる感覚神経活性化は、L5の後根神経節の活性化を介して近傍の交感神経節の特定交感神経を活性化し、L5背側血管付近でノルアドレナリンを分泌して血管内皮細胞から免疫細胞の遊走因子ケモカインを発現させることによって、血液脳関門にゲートを形成させます。また、人為的な微弱な電気刺激による局所神経の活性化でも、中枢神経系へのゲートが形成され、電気刺激部位によってゲートの場所を自在に移動させることができることを示しました。これらの知見は、神経刺激の導入部位、種類に応じて血管ゲートの形成される位置が規定されることを示しています。本実験では、マウスを微小重力状態で飼育した場合に、通常地球上で認められるL5背側の血管ゲートの形成がどうなるのか、他の部位に移動するのかを検証します(図2)。
2019年5月に実施した第4回小動物飼育ミッションでの長期飼育では、EAEを引き起こす中枢神経系タンパク質を認識する自己反応性T細胞とぶどう膜炎の病態を誘導する網膜タンパク質を認識する自己反応性T細胞の両方を移入したマウス6匹を「きぼう」で32日間飼育しました。微小重力環境での飼育後、6匹全頭を地上に生存帰還することができました。これらのマウスの解析を現在実施中です。
期待される成果
図3
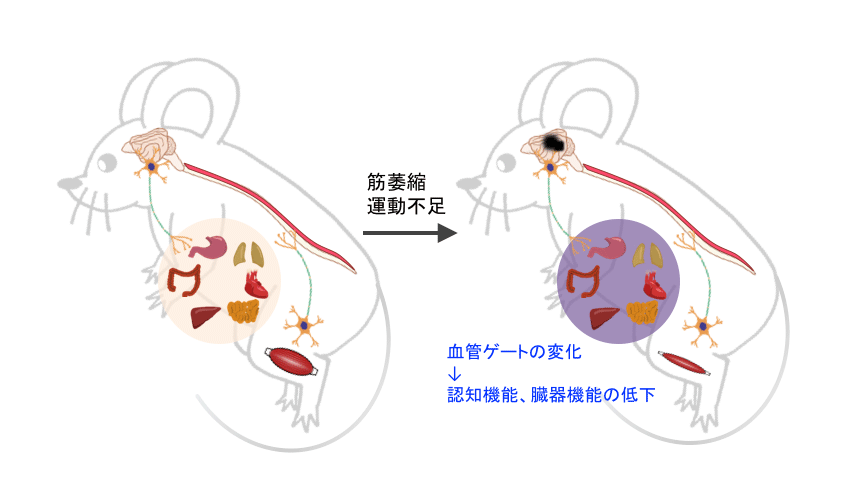
重力刺激を介する局所神経の活性化が担う炎症応答調節機構の重要性の証明に繋がり、宇宙飛行士はもとより、地上においても様々な病気に関連する炎症性疾患において、神経刺激を介した新しい制御法を開発できると考えられます。例えば鍼灸を参考にした神経刺激装置など、安価で簡便かつ科学的根拠に基づいた病気・病態の予防、治療法の基盤技術開発に結びつけることができます。さらに、ゲートウェイ反射の宇宙検証は、多くの人々が罹患する可能性のある認知症等の病態解明に繋がる可能性が高いと考えられます。神経細胞のシナプスネットワークの形成には転写因子NF-κB活性化制御が重要であることが知られています。ゲートウェイ反射に必要なIL-6アンプ活性化の神経での異常低下は、シナプスネットワークの減少に起因する認知症の病状に関与することが想定されます。また、神経活性化の異常は様々な臓器の機能異常に繋がります。つまり、寝たきり、運動の減少(肥満を含む)などで進行する認知症のメカニズムおよび加齢などによる臓器機能の低下が、重力刺激の減少によるゲートウェイ反射の低下による可能性が考えられ、今回の宇宙ミッションによるゲートウェイ反射検証は、将来的に認知症を含む様々な病態の解明と新規予防法に繋がる可能性が期待されます(図3)。
参考資料
関連文献
Higuchi H, Kamimura D, Jiang JJ, Atsumi T, Iwami D, Hotta K, Harada H, Takada Y, Kanno-Okada H, Hatanaka KC, Tanaka Y, Shinohara N, Murakami M.Orosomucoid 1 is involved in the development of chronic allograft rejection after kidney transplantation.
Ota M, Tanaka Y, Nakagawa I, Jiang JJ, Arima Y, Kamimura D, Onodera T, Iwasaki N, Murakami M.Chondrocytes play a role in the development of rheumatoid arthritis via TMEM147-mediated NF-κB activation.
Murakami M, Kamimura D, Hirano T.Pleiotropy and Specificity: Insights from the Interleukin 6 Family of Cytokines.
Stofkova A, Kamimura D, Ohki T, Ota M, Arima Y, Murakami M.Photopic light-mediated down-regulation of local α1A -adrenergic signaling protects blood-retina barrier in experimental autoimmune uveoretinitis.
Fujita M, Yamamoto Y, Jiang JJ, Atsumi T, Tanaka Y, Ohki T, Murao N, Funayama E, Hayashi T, Osawa M, Maeda T, Kamimura D, Murakami M.NEDD4 Is Involved in Inflammation Development during Keloid Formation.
Okuyama Y, Tanaka Y, Jiang JJ, Kamimura D, Nakamura A, Ota M, Ohki T, Higo D, Ogura H, Ishii N, Atsumi T, Murakami M.Bmi1 Regulates IκBα Degradation via Association with the SCF Complex.
Tanaka Y, Sabharwal L, Ota M, Nakagawa I, Jiang JJ, Arima Y, Ogura H, Okochi M, Ishii M, Kamimura D, Murakami M.Presenilin 1 Regulates NF-κB Activation via Association with Breakpoint Cluster Region and Casein Kinase II.
Atsumi T, Suzuki H, Jiang JJ, Okuyama Y, Nakagawa I, Ota M, Tanaka Y, Ohki T, Katsunuma K, Nakajima K, Hasegawa Y, Ohara O, Ogura H, Arima Y, Kamimura D, Murakami M.Rbm10 regulates inflammation development via alternative splicing of Dnmt3b.
Arima Y, Ohki T, Nishikawa N, Higuchi K, Ota M, Tanaka Y, Nio-Kobayashi J, Elfeky M, Sakai R, Mori Y, Kawamoto T, Stofkova A, Sakashita Y, Morimoto Y, Kuwatani M, Iwanaga T, Yoshioka Y, Sakamoto N, Yoshimura A, Takiguchi M, Sakoda S, Prinz M, Kamimura D, Murakami M.Brain micro-inflammation at specific vessels dysregulates organ-homeostasis via the activation of a new neural circuit.
Meng J, Jiang JJ, Atsumi T, Bando H, Okuyama Y, Sabharwal L, Nakagawa I, Higuchi H, Ota M, Okawara M, Ishitani R, Nureki O, Higo D, Arima Y, Ogura H, Kamimura D, Murakami M.Breakpoint Cluster Region-Mediated Inflammation Is Dependent on Casein Kinase II.
Arima Y, Kamimura D, Atsumi T, Harada M, Kawamoto T, Nishikawa N, Stofkova A, Ohki T, Higuchi K, Morimoto Y, Wieghofer P, Okada Y, Mori Y, Sakoda S, Saika S, Yoshioka Y, Komuro I, Yamashita T, Hirano T, Prinz M, Murakami M.A pain-mediated neural signal induces relapse in murine autoimmune encephalomyelitis, a multiple sclerosis model.
Harada M, Kamimura D, Arima Y, Kohsaka H, Nakatsuji Y, Nishida M, Atsumi T, Meng J, Bando H, Singh R, Sabharwal L, Jiang JJ, Kumai N, Miyasaka N, Sakoda S, Yamauchi-Takihara K, Ogura H, Hirano T, Murakami M.Temporal expression of growth factors triggered by epiregulin regulates inflammation development.
Murakami M, Harada M, Kamimura D, Ogura H, Okuyama Y, Kumai N, Okuyama A, Singh R, Jiang JJ, Atsumi T, Shiraya S, Nakatsuji Y, Kinoshita M, Kohsaka H, Nishida M, Sakoda S, Miyasaka N, Yamauchi-Takihara K, Hirano T.Disease-association analysis of an inflammation-related feedback loop.
Arima Y, Harada M, Kamimura D, Park JH, Kawano F, Yull FE, Kawamoto T, Iwakura Y, Betz UA, Marquez G, Blackwell TS, Ohira Y, Hirano T, Murakami M.Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier.
Ogura H, Murakami M, Okuyama Y, Tsuruoka M, Kitabayashi C, Kanamoto M, Nishihara M, Iwakura Y, Hirano T.Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction.
関連WEBサイト
続きを見る