Phospho-aging/MHU-6Mechanism of accelerated aging under microgravity

| 宇宙利用/実験期間 | 2020年 ~ 2023年 |
|---|---|
| 研究目的 | 本研究は、微小重力環境下で老化が加速するメカニズムの解明を目的とします。 |
| 宇宙利用/実験内容 | 本研究チームのこれまでの研究で、リンの過剰摂取が老化を加速することが分かっているので、「微小重力環境下における骨量減少によって骨から流出して血中へ流入するリンが老化を加速する」という仮説を立てました。宇宙飛行士から採取した血液・尿検体および軌道上で飼育したマウスを用いてこの仮説を検証することを目標としています。 |
| 期待される利用/研究成果 | 骨から流出するリンも経口摂取したリンと同様に老化を加速することが証明されれば、地上においては骨粗鬆症による骨量減少を防ぐことで老化が減速する可能性があります。これまで骨粗鬆症は老化の結果と考えられてきたが、老化の原因にもなることが証明されれば、骨量減少を防ぐ運動療法や薬物療法の開発・普及が新たな抗加齢医学として正当化されます。 |
| 関連トピックス |
|
|
詳細
研究代表者
研究分担者
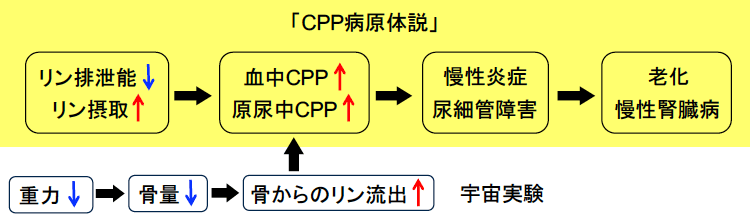
要旨微小重力環境では老化が加速したような病態が出現するが、メカニズムは不明です。我々は、早老症を呈する突然変異マウスの解析から、老化加速因子としてCPP(Calciprotein particle)を同定しました。CPPとは、リン酸カルシウムのコロイド粒子で、リン負荷(リン過剰摂取やリン排泄能低下)の際に血中や尿中で増加します。CPP は、あたかも「病原体」のようにToll様受容体で認識され、インフラマソームを活性化することから、我々は「CPPによる慢性炎症と細胞障害が老化を加速する」という仮説、すなわち「CPP病原体説」に至りました。微小重力環境では骨量が減少するが、骨からリンが持続的に血中へ流出すると、リン過剰摂取時と同様、CPPが増加して老化を加速する可能性があります。これを宇宙実験で検証するのが本研究の目的です。宇宙飛行士と軌道上で飼育したマウスから血液・尿・組織を採取して、①微小重力環境では、CPPの増加とそれに伴う病態(慢性炎症、腎尿細管障害など)が出現するか(biased approach)、さらに②種々のオミックス解析を行って、「CPP病原体説」を支持・修正・棄却するようなデータが得られるか(unbiased approach)、二つの異なるapproachで「CPP病原体説」を多角的・批判的に検証することを目指します。 実験の概要【実験1:マウスを対象とした実験】 高リン食で飼育している野生型マウスを「きぼう」内で飼育した後、軌道上でサンプル採取してから、地上に帰還させ、RNAや蛋白を抽出して解析します(オミックス解析を含む)。リン過剰摂取に加え、微小重力環境下では骨から流出するリンが上乗せされるため、地上のマウスに比べてリン利尿ホルモンであるFGF23や、血中・原尿中CPPが増加し、炎症や尿細管障害が加速すると予想されます。 本宇宙実験はドラゴン補給船運用22号機(SpX-22)で打ち上げられ、成功裏に実施されました。その後の地上対照実験を含め、サンプル解析を進めています。 【実験2:ヒトを対象とした実験】 宇宙飛行士を被験者とし、搭乗前、軌道上、帰還後に採血・採尿して解析します(オミックス解析を含む)。微小重力環境下では骨からリンが流出するので、リン過剰摂取の場合と同様、FGF23の上昇、血中・原尿中CPPの増加による慢性炎症、酸化ストレス、尿細管障害の所見が認められると予想されます。 これらの宇宙実験で「CPP病原体説」を支持するデータが得られれば、CPPを治療標的とした新たな抗加齢医学の開発が正当化されます。万一「CPP病原体説」を棄却するようなデータが得られた場合でも、オミックス解析のデータに基づいて、仮説の修正や新たな仮説の設定ができる可能性があります。 期待される成果骨から流出するリンも、経口摂取したリンと同様に老化を加速することが証明されれば、地上においては骨粗鬆症による骨量減少を防ぐことで、腎機能低下や非感染性慢性炎症などの老化を加速する要因が軽減する可能性があります。これまで骨粗鬆症は老化の結果と考えられてきましたが、老化の原因にもなることが証明されれば、骨量減少を防ぐ運動療法や薬物療法の開発・普及が新たな抗加齢医学として正当化されます。 参考資料
関連リンク |
|