Stress & Inflammatory Response/ MHU-9Strategies for Overcoming Space Stress Through Reinforcing Defense Mechanisms

| 宇宙利用/実験期間 | 2024年 ~ 2025年 | ||||||
|---|---|---|---|---|---|---|---|
| 研究目的 | 転写因子NRF2活性化が宇宙環境における健康維持にどのように貢献できるのか、マウスモデルを用いて調べます。特に、宇宙環境における免疫機能変化を、モニタリングマウスの発光イメージングにより解析し、宇宙ストレス克服への応用を目指します。 | ||||||
| 宇宙利用/実験内容 | 宇宙環境における免疫機能低下の様子を、サイトカインIL6遺伝子制御下にルシフェラーゼを発現する炎症モニタリングマウス(IL6-Luc)と発光イメージング解析技術を駆使して、動物個体レベルで解析します。また、KEAP1ノックダウンマウス(KEAP1-KD)により、NRF2とその抗炎症作用が活性化しているマウスの宇宙滞在を行い、NRF2活性化が宇宙環境における健康維持にどのように貢献できるのかを調べます。 | ||||||
| 期待される利用/研究成果 | NRF2活性化が宇宙ストレス克服に有効であること実証できれば、今後、人類の宇宙旅行・長期滞在の際に、NRF2活性化をターゲットにするリスク軽減戦略を立案することができるようになり、人類の宇宙進出を推し進める基盤確立につながるものと期待されます。また、本研究から得られる知見は地上における疾患克服に応用・展開できるため、高齢化社会における加齢性疾患の克服にNRF2活性化剤が活用できるようになることが期待されます。 | ||||||
| 関連トピックス |
|
||||||
|
詳細
概要
研究代表者
研究分担者
要旨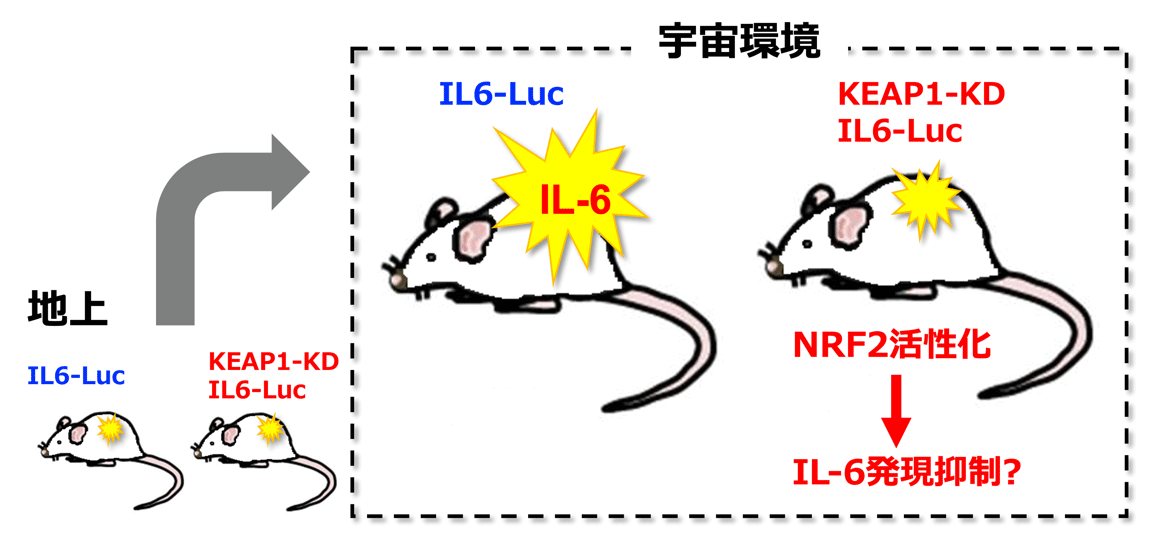
宇宙環境では、微小重力や宇宙放射線等の影響のために、筋肉や骨量の減少、および免疫機能低下が惹起されると考えられています。地上でも加齢に伴い同様の現象が観察されることから、宇宙環境は老化の加速モデルとして活用することができます。私たちは先に、生体防御に働く転写因子NRF2の遺伝子欠失マウスを国際宇宙ステーション(ISS)に送り、そのマウスを長期間飼育することで、宇宙環境での健康維持に対するNRF2の機能貢献を実証しました。しかし、欠失モデルではなく活性化モデルにおいてNRF2が宇宙ストレス軽減に働くのかは未だ検証できていません。 実験の概要人類の宇宙進出が身近になった現在、私たちが宇宙環境に滞在した場合に直面する健康面でのリスクを明らかにし、いかにそれらリスクを誘発する宇宙ストレスを回避するか、その対策法を開発することは重要課題です。宇宙環境では、筋肉量と骨量は地上よりもそれぞれ2倍、 10倍のスピードで減少することが知られています 。また、免疫機能低下が起こり、感染やアレルギー疾患の発症リスクが増大する可能性が高いと指摘されています。地上環境でも加齢に伴い、筋肉量や骨量の減少が起こり、寝たきりや骨粗しょう症を引き起こすこと、また、免疫機能低下により感染症リスクが高まることから、宇宙環境は重要な老化加速モデルを提供するものと考えられます。 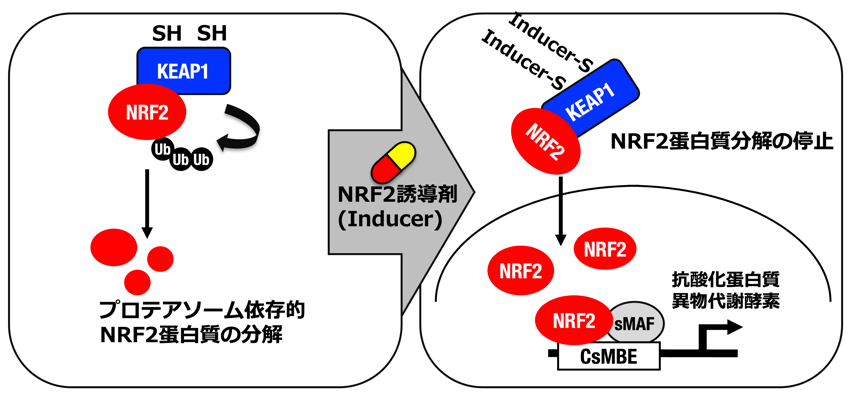
酸化ストレスや外来毒物など地上での環境由来ストレスに対して、転写因子NRF2が抗酸化・異物代謝に関わる遺伝子群の発現を誘導して、生体の恒常性維持に貢献しています(図)。NRF2は、通常状態ではユビキチンE3リガーゼであるKEAP1によりユビキチン化され、プロテアソームにより迅速に分解されます。また、KEAP1はストレスセンサーとしても機能し、ストレスを感知するとNRF2のユビキチン化を停止します。それにより安定化したNRF2は核内に蓄積して、生体防御酵素群の遺伝子の転写反応を活性化します(図)。 NRF2活性化による生体防御機能の増強作用は大きな注目を浴びており、様々な疾患の予防・治療への応用を目指して、多くの製薬企業によりNRF2誘導剤の開発が進んでいます。それらの中には、既にアメリカ食品医薬品局(FDA)と医薬品医療機器総合機構(PMDA)により認可されたものもあります。研究代表者らはこれまでに、マウス遺伝学およびNRF2誘導剤を用いた解析を実施し、NRF2活性化が、生体に酸化ストレスに起因する様々な刺激に対する耐性を付与することを明らかにしました。さらに、研究代表者らは、ヒトIL6遺伝子の制御下でルシフェラーゼ遺伝子を発現する炎症モニタリングマウス(IL6-Luc)の樹立に成功し、NRF2がIL6などの炎症性サイトカインの遺伝子発現を抑制して、強力な抗炎症作用を示すことを実証しました。このような研究から、NRF2活性化は宇宙ストレス克服の有効な手段になる可能性が高いと考え、それを検討・実証する目的で本研究の着想に至りました。 本研究では、宇宙ストレスが免疫機能に与える影響をモニタリングするために、IL6-LucマウスをISSで飼育し、世界で初めて、宇宙における遺伝子発現の発光イメージング撮像によるモニタリングを行います。さらに、NRF2活性化が宇宙環境における健康維持にどのように貢献できるのかを調べるために、NRF2が活性化しているKEAP1ノックダウンマウス(KEAP1-KD)についても、同時に飼育し、特に、宇宙ストレスによる免疫機能低下をNRF2活性化が食い止めることができるのか否か検証を行います。発光イメージング撮像には、ISS「きぼう」に設置された遺伝子機能発光イメージング解析装置(TELLAS)を使用します。ISSでの2週間の飼育後に軌道上で採取したサンプルについて、主要臓器の遺伝子発現解析や血中代謝物解析を網羅的に行います。宇宙環境への適応にNRF2活性化が有効であることの検証のみならず、その成果を地上でも起こる加齢疾患の克服への応用に活用することに挑みます。 本宇宙実験はドラゴン補給船運用31号機(SpX-31)で打ち上げられ、成功裏に実施されました。並行して行った地上対照実験を含め、サンプル解析を進めています。 期待される成果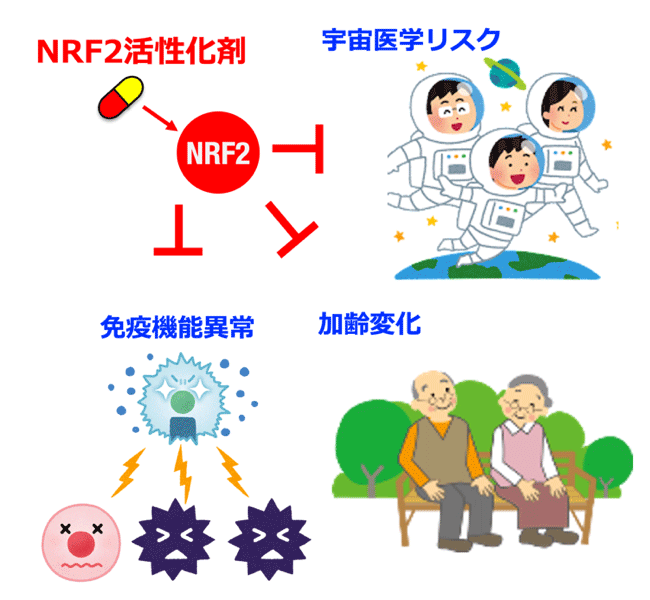
本研究の成果として、NRF2活性化が宇宙ストレス克服に有効であることが明らかになれば、人類が宇宙滞在する際のリスク軽減にNRF2をターゲットとする創薬を活用する戦略が有効であることが実証されます。これは、人類の宇宙進出を推し進めるための科学基盤確立につながるものと期待されます。また、本研究から得られる知見を、人類の加齢性疾患克服への応用・展開を図ることができれば、NRF2活性化剤の摂取などにより、宇宙ストレス克服法のみならず、地上でも起こる加齢性疾患克服への応用活用が期待されます。 |
|||||||

山本 雅之 YAMAMOTO Masayuki
東北大学 東北メディカル・メガバンク機構 機構長
1983年、東北大学大学院医学研究科修了。米国留学後、筑波大学教授、日本学術会議会員などを歴任。2007年、東北大学医学系研究科医化学分野教授就任。医学系研究科長・医学部長、副学長などを経て、現在は東北メディカル・メガバンク機構機構長として、東日本大震災からの復興に取組むとともに、未来型医療を推進。2018年、第3回小動物飼育ミッション研究代表者として、世界初のNRF2遺伝子ノックアウトマウスのISS長期飼育・全匹生存帰還に成功。東北大学大学院医学系研究科 医化学分野
東北メディカル・メガバンク機構
ibSLS(Integrated Biobank for Space Life Science)




