高品質タンパク質結晶生成実験 成果事例
有竹 浩介
研究の背景・面白さについて
プロスタグランジン(PG)は、生体膜に含まれるアラキドン酸から、シクロオキシゲナーゼという酵素の作用により生成される様々な生理活性を持つ一群の特殊な脂肪酸です。その中でプロスタグランジンD2(PGD2)は、アレルギーの発症や進展に関わるマスト細胞や免疫担当細胞において活発に産生され、気管支喘息、アトピー性皮膚炎などのアレルギーや様々な炎症反応に関与します。一方、脳の主要なPGとして産生され、睡眠調節に重要な役割を果たします。その合成酵素にはアレルギーや炎症時のPGD2産生に関与する造血器型PGD合成酵素(H-PGDS)と睡眠時のPGD2産生に関与するリポカリン型PGD合成酵素(L-PGDS)との2種類があります。生体内で、同じ材料からつくられる全く同じ物質が、かたや炎症やアレルギーの進行に関わり、中枢神経系では睡眠を誘発する、つまり、作られる場所や作用する場所によって全く違う働きを示すこと、更に同じ物質が作られる場所や作用する場所によって異なる酵素から作られるというのは生物の不思議です。
私たちは、様々な病態におけるPGD2の機能について研究を続け、共同研究グループがデュシェンヌ型筋ジストロフィー患者の筋肉で造血器型PGD合成酵素(H-PGDS) の発現が増強していることを偶然に発見しました。デュシェンヌ型筋ジストロフィーは、X染色体上にあるジストロフィン遺伝子の異常で生じる遺伝性疾患で、人種や地域、国を問わず男児約3,500人に一人という比較的高頻度に発生する筋委縮を伴う進行性の難病です。ジストロフィンは筋肉細胞の裏打ちタンパク質であり、細胞1つ1つを支えています。この遺伝子の異常によりジストロフィンタンパク質が全く存在しないことで、非常に脆弱な筋肉となり、わずかな負荷で容易に筋肉に炎症が起きてしまい、その後連鎖的に炎症が進行します。
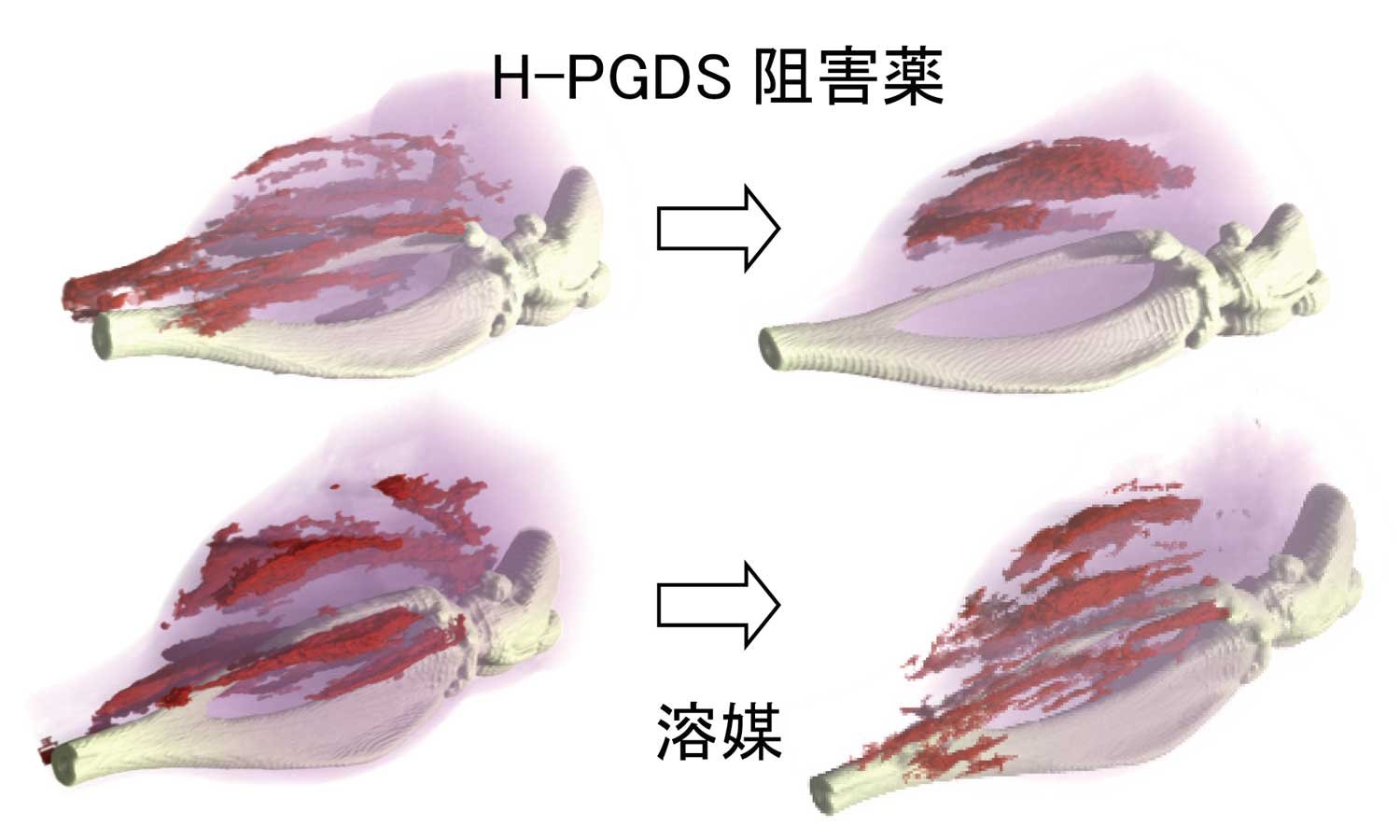
私たちは、デュシェンヌ型筋ジストロフィーのモデルマウスであるmdxマウスにおいても炎症がおきた筋肉やその周辺でH-PGDSが発現することを証明しました。そして、mdxマウスに偶然に発見したプロトタイプのH-PGDS 阻害剤 (HQL-79) を投与すると、筋壊死病態が軽減されることを証明しました(図1)。これらの結果は、H-PGDSによって産生されたPGD2が筋壊死の病態の進行に重要な役割を果たすことを示しています。また、この成果はPGD2の産生を抑制し、PGD2の情報伝達を制御することで、これまで遺伝子治療や幹細胞移植治療しか治療法がないと考えられていたデュシェンヌ型筋ジストロフィーをPGD2の産生を制御することで薬物治療できること、少なくとも病気の進行を大幅に軽減できる可能性を示すものです。
そこで、より選択的かつ強力で、副作用の少ないH-PGDS阻害薬の創薬開発に着手しました。効率的に創薬するためには、H-PGDSの触媒部位の精密な微細構造を知る必要があります。例えるなら、阻害薬と酵素 (H-PGDS) の触媒部位の関係は、鍵と鍵穴の関係にあります。従来は、まず既存の何千何百という化合物をランダムに試験して、阻害活性の強い化合物を選び出し、更に化学修飾するなどして、最適な薬物を選出してきました。すなわち、多くの鍵を片っ端から鍵穴に入れてみて、鍵が廻るかどうか調べていたのです。
H-PGDSタンパク質の微細構造を知るためには、X結晶構造解析が有用です。微細構造(鍵穴)の形がわかっていれば、阻害薬(鍵)を理論的に分子設計できます。また、既存の化合物をコンピューター上で試験することもでき、極めて効率的に最適な薬物を選び出すことができるのです。
高品位な結晶の生成を目指して、国際宇宙ステーションを利用した結晶化に取り組んでいます。
宇宙実験の結果・貢献ポイントについて
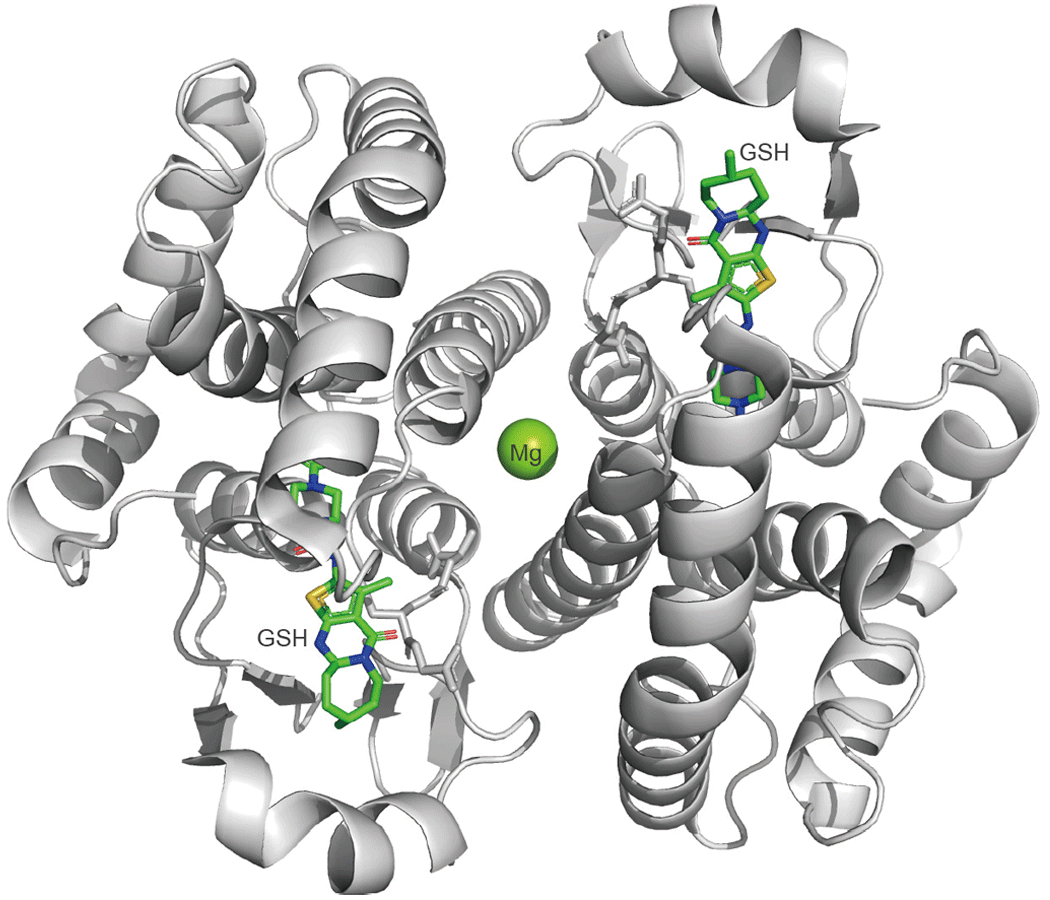
H-PGDSは、σ型のグルタチオンS転移酵素 (GST) の遺伝子ファミリーに属し、他のGSTと同様に生体内ではホモダイマーを形成し、分子量約52kDa (ダイマーとして) です。その中心には、Mg2+ が配位し、PGH2をPGD2に異性化する酵素反応には、補酵素のGSHを絶対的に要求する酵素です (図2)。このH-PGDSによって合成されたPGD2がデュシェンヌ型筋ジストロフィーの筋障害や炎症反応を悪化させるので、強力かつ選択的なH-PGDS阻害薬の分子設計を目指して、「きぼう」利用高品質タンパク質結晶生成実験により、プロトタイプの阻害薬 (IC50 ≑ 5 μM) とH-PGDSの複合体結晶化を試み、1.4 Å 程度の分解能の結晶が得られました。この情報を基に選択的かつ強力な阻害薬 (IC50 ≑ 10 nM) が理論的に分子設計、化学合成されました。その新規な阻害薬の中から、国内製薬企業により有効性と安全性が確認された阻害剤が、現在、ヒトでの安全性も確認され、2021年1月からデュシェンヌ型筋ジストロフィーを対象疾患として第3相臨床試験が行われています。更に、宇宙実験を重ね、新規な阻害薬とH-PGDSの複合体結晶化を行うと、地上ではクラスター状の結晶ができるのに比べて宇宙では高品位な単結晶が出来、かつ極めて高い分解能 (0.95Å)を得ることができました(図3)。この結果、触媒部位を構成するアミノ酸とGSH、阻害薬の詳細な3次元立体構造が明らかになったばかりでなく、阻害薬やGSHの結合や触媒部位の立体構造の維持にも重要な水分子も同定することができました。この成果は、基本骨格の異なる新規な阻害薬の分子設計やスクリーニングへの応用にも有用な情報となりました。
今後の研究について
デュシェンヌ型筋ジストロフィーは、ジストロフィン遺伝子変異によって発症する難治性の疾患であり、長期にわたって薬物を摂取する必要があります。また、原因遺伝子が同じであるにもかかわらず、患者によって病態の進行度も異なることも知られています。従って、治療薬に対する反応性や代謝も多様性があることが予想されます。
また、デュシェンヌ型筋ジストロフィーは、筋力の低下ばかりでなく、呼吸障害や心筋障害の合併も伴う疾患ですが、この心筋障害にもH-PGDSが関わることや、阻害薬が心筋障害にも有効であることが実験動物を用いた検討から明らかとなってきました。 今後も、「きぼう」利用高品質タンパク質結晶生成実験の機会を利用して、基本骨格の異なる新規なH-PGDS阻害薬の分子設計やスクリーニングを継続して、筋ジストロフィー患者の治療薬開発に貢献したいと考えています。

有竹 浩介 (ありたけ こうすけ)
第一薬科大学 薬学部 薬品作用学分野 教授

濵村 賢吾 (はまむら けんご)
第一薬科大学 薬学部 薬品作用学分野 講師