高品質タンパク質結晶生成実験 成果事例
森本 幸生
研究の背景・面白さについて
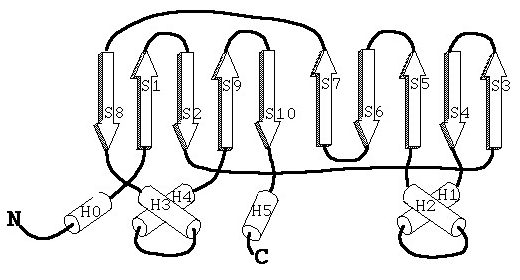
矢印はβストランド、筒はαヘリックスを示します。
ヒト・動物・植物・微生物に至るまで、その生体内での種々の生理機能はタンパク質が担っています。どのようなタンパク質が存在するのか、それぞれどのような働きをするのか、その興味は千差万別で、科学者たちはそれぞれの専門に応じた立場で研究を進めています。私たちはその中でも、タンパク質が織りなす立体構造と生理機能の関係を探っています。例えば、息を吸った後にどのように酸素を体内中に運ぶのか、食事をした後どのように栄養分が作り出されていくのか、などなどです。生体が正常に働くためには、このような種々の役割がきちんと働かないといけません。この中でどれか一つでも欠けると息が苦しくなる、栄養不足で運動ができなくなるなど病気を引き起こします。しかし、このような重要なタンパク質でもその寿命は永遠ではなく、年をとるにつれてだんだんとその働きは劣化していきます。ある程度の修復は行われますが、最終的には不要タンパク質となり、それは速やかに体外に放出しなければなりません。例えて言えば、そのまま放っておけば、家じゅうがごみの山になってしまって生活ができなくなるからです。いろいろな機能を持っているタンパク質の中でも、その不要なタンパク質を分解・除去する機能を持ったタンパク質も存在します。プロテアソームと名付けられ、他の(例えば肉を食べた後に肉を分解するタンパク質分解酵素などの)タンパク質分解酵素と似ている部分と、まったく異なる部分を持つ酵素です。
プロテアソームは1980年代に、細胞内のタンパク質を分解する、とても大きな(いろいろなタンパク質が組み合わさってできている)複合体を形成しているものとして発見され命名されました。通常、タンパク質はペプチド鎖が折りたたまれた球状の形をした分子で、その中にそのタンパク質が持つ固有の機能を行う場所を持っています(活性部位)。このプロテアソームは、28個のサブユニット(個々のタンパク質)からできており、その活性部位は、複合体の中に点在しています。28個のサブユニットは全く異なるわけではなく、ほとんど共通の立体構造を持っています(真核細胞では14種、原核細胞では2種)。それを大まかに示すと図1のようになります。
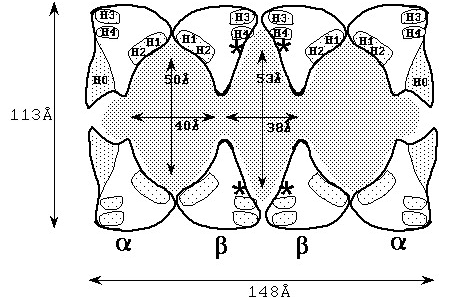
白抜きの部分がサブユニット、灰色部分は空洞、活性部位は*、ヘリックスが位置するところはHと表記。左から、α―β―β―αリングです。
N末端からはじまり、βストランドが折り合わさって逆平行βシートを作ってその間を数本のαヘリックスがつないでいるような構造です。これらが7個集まってリングを形成し(この7個、という組み合わせは生体内物質ではかなり特殊な部類に入る)αあるいはβリングと呼ばれます。このリング同士が、α―β―β―αと積み重なって、結果的に横から見ると図2のような空洞を持った樽状の大きな形を形成します。
これは横から切断した様子を示していますが、中央およびその両端に大きな空洞があることがわかります。この酵素が発見された当時は、このような空洞をもつことを予想しておらず、今のような高精細の電子顕微鏡像も得られない状況で、構造的に大変興味深い研究対象でした。
このプロテアソーム複合体(分子の大きさを示す沈降係数が20Sであることから、20Sプロテアソームと呼びます)は、図1(図2の白抜き部分)の構造の中に、タンパク質を分解する活性部位を持っていますが、図2から想像できるように、それは複合体の中である程度の位置の対称性をもって、点在します。同時に、それぞれの活性部位が、連動・協同して機能することも予想できます。20Sプロテアソームは、単にタンパク質を分解するだけではなく、免疫の抗原を提示するようなペプチドの切り出し機能も持っていることが明らかになりました。この機能は免疫機構を持つ哺乳動物のプロテアソームに特徴的な機能です。さらにこの分解活性を止めると細胞死(アポトーシス)を誘導する(細胞が不要タンパクで破裂寸前になり細胞機能が停止する)ことも明らかになり、このような免疫応答機能が、立体構造のどこからくるのか、に非常に大きな興味が出てきました。さらに2000年初頭ごろより、がん細胞でこのプロテアソームが高発現していることがわかり(理由はがん細胞攻撃のための免疫グロブリンの大量発現によるそれらの処理のため)、その分解活性を止めることでがん細胞の増殖を抑えられることがわかりました。その結果、活性阻害剤が抗がん剤として利用できることが提唱されました。このような背景から、プロテアソームの構造の特徴と、機能の発現に強い興味を持ち、同時に効果的な抗がん剤の開発を目的として、立体構造解析の研究を行ってきています。
宇宙実験の結果・貢献ポイントについて
先にも述べたようにこのプロテアソームは、20Sの重さ、分子量で表記すれば約3万ダルトン×28個で75万ダルトンの大きさを持っています。このような大きなタンパク質のX線構造解析では、通常のタンパク質結晶解析、結晶化とは種々異なった難題が出てきます。ひとつは分子サイズが大きいため結晶格子も大きくなり、実験室系のX線回折装置では測定できないこと。もう一つは、格子が大きいため良質で安定な結晶が得られないこと、です。ここで良質な結晶とはどのようなものでしょうか? ひとつには見た目にひびなどがなく、透明できれいな、角や陵がはっきりした結晶でしょう。さらに回折の観点でいえば、分解能(X線の反射能力)が高い(小さな点まで明確に分離して判別できる)結晶、ということになります。
タンパク質を結晶化させる際には、高純度に精製した目的タンパク質を、結晶化のための沈殿剤などと混合し、その濃度比率を変化させることにより、タンパク質分子を液相から固相へ移動させます(結晶化)。その際にはさまざまな物理化学的な因子が影響します。温度、濃度、pH、イオン強度、溶質の種類などです。これらはある程度経験により、また試行錯誤により種々のスクリーニングを行って進めますが、どうしても抑制、制御できない項目に重力があります。通常の(分子量が数万程度の)タンパク質であれば、重力の影響は溶液中での自由拡散と相殺され無視できますが、それでも溶液中の局所的な濃度勾配には少なからず影響があります。特に溶液中の対流には大きな影響が出ます。ここで、重力を軽減あるいはなくした状態で結晶化が行えれば、少なくとも溶液中の対流を抑止しタンパク質と溶質の相互作用だけで、結晶化が進行するものと考えられます。
このような考えで国際宇宙ステーション・「きぼう」日本実験棟内でプロテアソームの結晶化を行いました。図3に地上および宇宙で得られた結晶の顕微鏡写真を示します。
地上、宇宙とも適切な大きさの結晶が得られました。宇宙結晶の方が若干厚みがあるように見えますし、地上結晶の方は少し沈殿があるのがわかります。見た目にはこれ以上のことはわからず、分解能などは実際にX線を当ててみないとわかりません。さらに後述するように、顕微鏡観察からでは絶対に出てこない結晶の質について考察します。
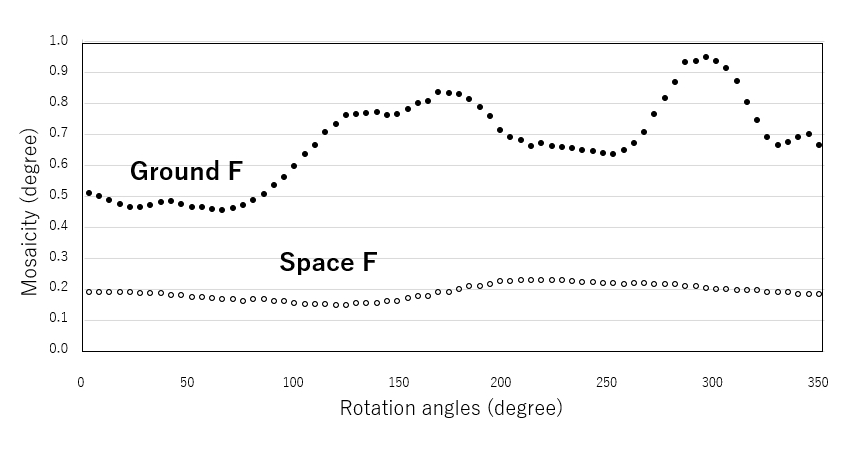
上記2種類の結晶をSPring-8大型放射光施設で回折実験を行いました。最大分解能はそれぞれ、2.24Å(地上)、1.93Å(宇宙)で、宇宙結晶の方が高い分解能でした。データ完全性の観点から、解析上の分解能はそれぞれ、2.92Å、 2.74Åでした。ここで、回折データ処理を行った際の結晶のモザイシティーという物理量を評価しました(図4)。モザイシティーとは、肉眼で見える結晶において、ほぼ完全な微小結晶領域(ブロックのように考える)を積み重ねた際のブロック同士のずれ、に相当する量です。これは肉眼では絶対に観察できません。
このプロットから、地上結晶では約180度の回転ごとに周期があり、モザイシティーは0.5°から0.8°近くまでを上下していますが、宇宙結晶では1回転の間に約0.2°とほとんど上下変動がないことが見て取れます。地上結晶での変動は、X線にあたった結晶からの回折斑点が、ある方向ではモザイシティーが高くなることを示しており、3次元結晶のある軸方向に微小完全結晶(ブロック)のずれが大きくなっていること意味します。一方宇宙結晶ではそれが見られませんので、結晶の3軸方向ともずれが最小範囲で収まっていることを示しています。これは結晶が3軸方向とも安定にどんどん積み重なっていける可能性が高いことを意味します。従って大きな良質の結晶が得られる、ということになります。
このようにして得られたプロテアソームの結晶からの解析の結果、図5に示すように阻害剤(悪性骨髄腫の特効薬)が活性部位に結合している様子が、各原子とアミノ酸の相互作用を解釈できる精度で得ることができました。
この図5左は、地上結晶では分解能が低く、この場所は水分子あるいは沈殿剤(MPD)が位置しているように「見えて」いましたが、宇宙結晶でははっきりと阻害剤分子の電子密度が現れ阻害位置を決定することができました。
同様の観点から、ヒト赤血球のプロテアソームとの阻害剤結合解析を進めており、現在まだ阻害剤結合型の構造は得られておりませんが、図5右のように、酵母プロテアソーム(青)と構造を比較すると、阻害剤結合位置(阻害剤のスレオニン側とは反対の芳香環部位)での接触(緑)に、酵母とは変異しているアミノ酸が位置していることから、ヒトでの結合様式はまた異なっているものと予想されます。
今後の研究について
これまで説明したプロテアソームの活性部位と阻害剤の関係は、20Sプロテアソームの分子内部の1か所のみについて説明しました。冒頭述べたように20Sプロテアソームは、28個のサブユニットの会合体であり、その活性部位も上述に相当する機能箇所は6か所あります。また分解活性部位の種類も少なくとも3様式が提唱されていることから、分子内での分解機構そのものは、非常に複雑な活性部位の連動機構から成り立っているものと考えられます。この解析を通して、阻害剤導入の時系列を追跡することによって、分子内の6か所の活性部位に、時間差で結合している様子をとらえることができました。まったく同時に結合するのではなく、一部が結合したのち、他所への結合が見られるのです。また必ずしも活性部位ではなく、基質(分解される側)の侵入経路をふさぐ形の阻害効果も立証できつつあります。これらの活性機構の連動あるいは非協調、非特異的結合が抗がん剤の副作用抑制につながるものと考えられますので、局所的な結合様式の解析だけではなく、全体構造を俯瞰しながらの解析が必須であり、宇宙での良質な結晶作成を行いつつ、これを進めていきたいと考えています。

森本 幸生 (もりもと ゆきお)
京都大学 複合原子力科学研究所
放射線生命科学研究部門 生体分子構造研究分野 教授