高品質タンパク質結晶生成実験 成果事例
水素原子レベルでの酵素反応機構・阻害剤結合機構の解明を目指して
中村 照也
研究の背景・面白さについて
遺伝情報を担うDNAは、紫外線や化学物質、活性酸素種などにより損傷を受けます。生物はこのようなDNA損傷を回避、修復する機構を備えることで、DNAの遺伝情報を正確に維持しています。DNA損傷を回避する機構の一つに、DNAの材料であるヌクレオチドの中から酸化損傷を受けたヌクレオチド (酸化ヌクレオチド) を分解する機構が存在します。ヒトにおいてはMTH1という酵素がいくつかの酸化ヌクレオチドを加水分解することで、DNA中に酸化損傷が蓄積するのを防いで突然変異を抑制しています。このMTH1の幅広い基質特異性の解明には、X線結晶構造解析が必須です。一方で、MTH1はがん細胞で高発現しており、2014年のNature誌にMTH1阻害によるがん細胞増殖抑制効果が報告されました。それ以来、MTH1は新規作用機構の抗がん剤ターゲットとしても注目され、現在も様々なグループによってその有効性に関する研究が行われています。
宇宙実験の結果・貢献ポイントについて

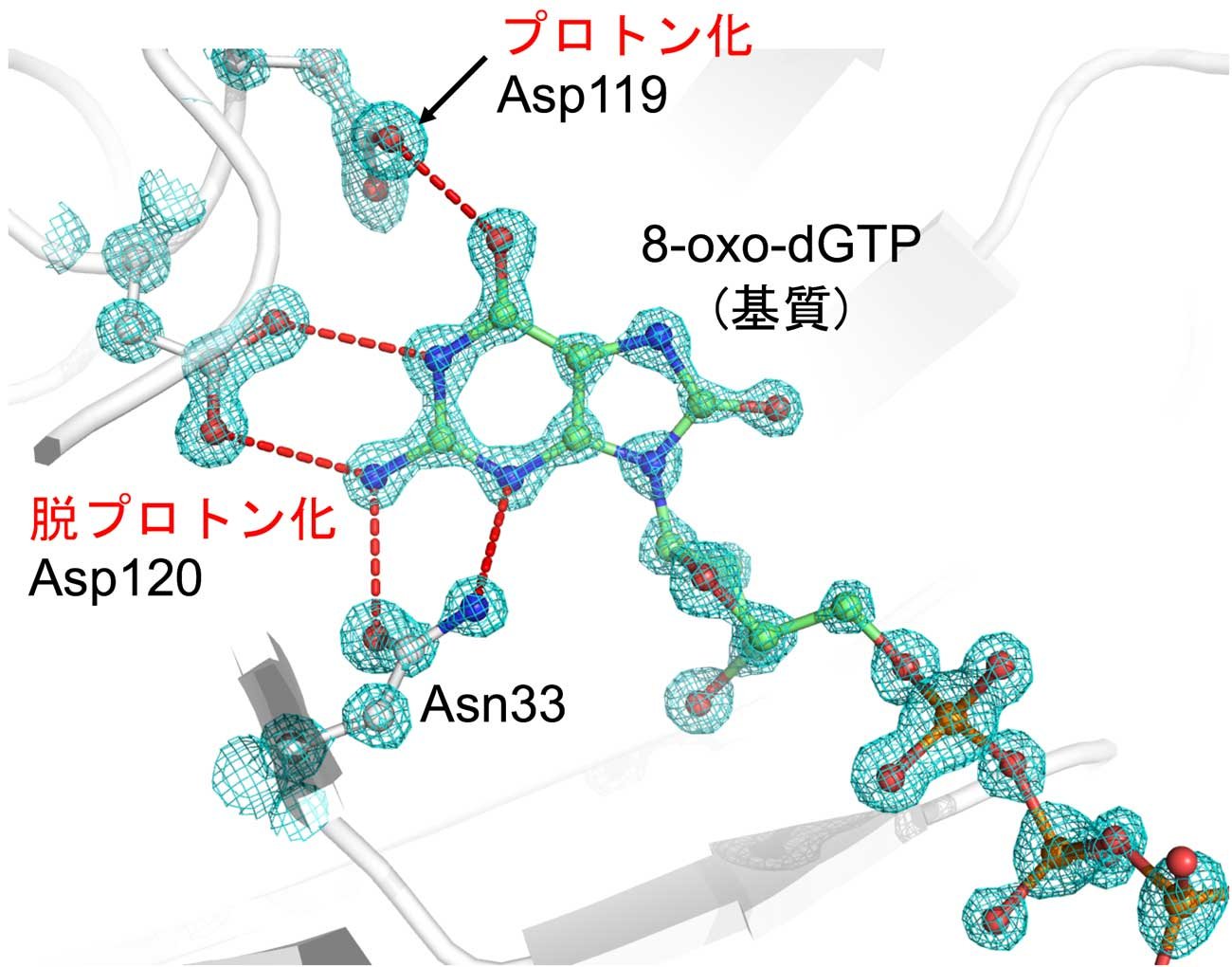
これまでに我々は、「MTH1は基質に応じて活性部位のプロトン化状態を変えることにより、幅広い基質特異性で酸化ヌクレオチドを認識する」という構造学的基盤を提案し、阻害剤結合においてもこの活性部位のプロトン化状態の変化が重要であることを示しました(Waz S. et al., J. Biol. Chem., 2017)。タンパク質構造中のプロトン化状態 (水素原子の位置)を詳細に議論するには、1.0 Åを超える高分解能の結晶、すなわち高品質かつ大型の結晶を調製することが必要です。我々は、地上での結晶大型化実験を進めると同時に、JAXA高品質タンパク質結晶生成実験に参加しました。プロジェクトを通じて、我々の供給したサンプルの宇宙実験に適した結晶化条件の最適化だけでなく、単分散性の評価、必要に応じた追加精製なども行っていただき、より高純度なサンプル調製法もわかりました。また、MTH1の結晶化には、結晶の核形成を促すミクロシーディングが必須ですが、微小重力下での結晶化におけるミクロシーディング法は確立されていたため、ミクロシーディングが必須な結晶化サンプルでも宇宙実験を行うことができました。第2期シリーズ第6回の宇宙実験において、これまでの最高となる1.04 Å分解能を示す高品質結晶を得ることができ(図1)、そのX線結晶構造を精密化しました(図2)。MTH1では、上述のように活性部位に存在する2つのAsp残基のプロトン化状態が基質、阻害剤の結合に応じて変化すると我々は提案しています。AspやGlu残基などが持つカルボキシ基のプロトン化状態はカルボキシ基のC-O間の結合距離から議論することができますが、そのためには1.0 Å分解能に迫る高分解能、高精度の精密構造が必要です。宇宙実験の1.04 Åという高分解能データでAsp残基の結合長解析を行うことができ、Asp119のC-O間の距離は、それぞれ1.206(15)、1.311(15) Å、Asp120の場合は、1.236(13)、1.264(14) Åと決定できました。この結果、基質(8-oxo-dGTP)結合時の2つのAsp残基のプロトン化状態について、Asp119がプロトン化、Asp120 が脱プロトン化状態であることがわかりました。このように宇宙実験で得られた高品質の結晶を用いてより高い精度でプロトン化状態を議論することが可能となり、これまでに提案していたMTH1の幅広い基質特異性の構造学的基盤を支持する結果を得ました(Nakamura T. et al., Int. J. Microgravity Sci. Appl., 2019)。
本研究は、熊本大学名誉教授、尚絅大学・尚絅大学短期大学部学長の山縣ゆり子先生との共同研究です。
今後の研究について
MTH1の酵素反応機構、阻害剤結合機構を実証するには、活性部位全ての水素原子を観察することが必要不可欠であり、特に酵素反応機構においては、水素原子の動きをも明らかにすることが求められます。今後も、宇宙実験を通じて得られた情報と培った結晶化技術を用いて、MTH1の水素原子レベルでの構造生物学的研究を展開していきたいと考えています。

中村 照也(なかむら てるや)
熊本大学大学院先導機構 大学院薬学教育部 准教授

山縣 ゆり子(やまがた ゆりこ)
熊本大学 名誉教授、尚絅大学・尚絅大学短期大学部 学長




