
Technical Information
03

これまでの高品質タンパク質結晶生成実験プロジェクトで蓄積した経験によって、打ち上げ前のタンパク質試料の性状を正確に把握し、必要に応じてその性状の改善を行うことで宇宙実験の効果を最大化できることがわかってきました。
一般的なタンパク質結晶化実験ではSDS-PAGEなどでの純度検定を中心とした性状確認作業を行っており、結晶化に十分な純度のタンパク質試料が得られ次第結晶化作業に移行しますが、JAXAでは複数の性状確認作業によって、より正確にタンパク質試料の性状を把握します。
性状確認作業、性状改善作業および結晶化作業に用いる装置類については以下のページに掲載しています。
JAXA実験室紹介純度検定として、受け入れ時にSDS-PAGEを行います。熱変性時の温度、用いる界面活性剤の種類(SDS or LDS)によって電気泳動パターンに差異が出ることがあるため、最も再現性の良い電気泳動条件を受け入れ時に見出しておきます。
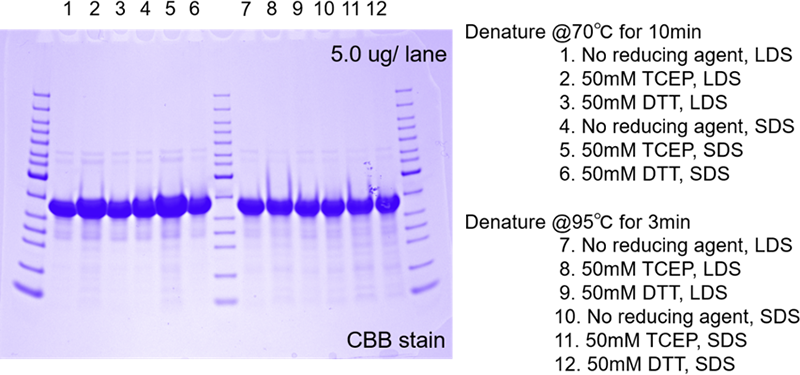
図1. 微生物由来分泌タンパク質のSDS-PAGE
熱変性温度、還元剤の種類、界面活性剤の種類を変えて、SDS-PAGEを行います。疎水性が強いタンパク質では熱変性の温度が高いと凝集体が生じてタンパク質の分子量から予想される泳動度とは異なる泳動度になる場合があります。
純度よりも宇宙実験の結果に大きく影響する要素として、均質度が挙げられます。純度が高くても均質度、特に電荷の均一性が低いと結晶化の成功率が下がるうえ、結晶品質が低くなりやすいです。電荷の均一性を検定するために高分解能イオン交換樹脂を用いたイオン交換クロマトグラフィーやNative PAGEなどで電荷のばらつきを検定します。また、ヘテロオリゴマーを取り扱う場合には4次構造の均質度をBN PAGEで検定します。糖鎖修飾が疑われる場合は2D PAGEや質量分析などを行うこともあります。
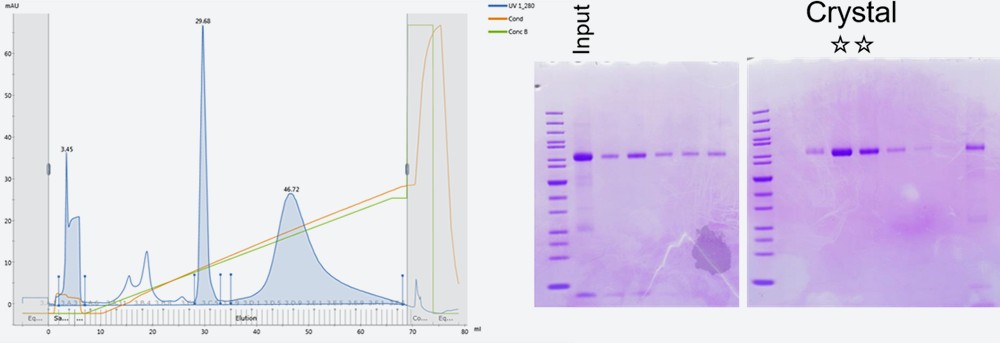
図2. ヒト由来タンパク質の陰イオン交換クロマトグラフィーのクロマトグラム(左)とそのSDS-PAGEの結果
このタンパク質はアフィニティー精製の後にSDS-PAGEで純度検定を行った結果、結晶化に十分な純度と思われる試料でしたが、陰イオン交換クロマトグラフィーを行った結果、素通り画分、200mM NaCl付近の画分、300-500mM NaCl付近の画分の三か所に目的のタンパク質が存在していました。ピークがシャープな200mM NaCl付近の画分では結晶化に成功しましたが、陰イオン交換クロマトグラフィー前、素通り画分、300-500mM NaCl付近の画分では結晶が得られませんでした。
一般的に熱安定性の高いタンパク質の方が結晶化しやすいことが知られておりますが、同じタンパク質であってもタンパク質が溶けているバッファーのpHやイオン強度、添加剤の有無などによって、溶液中での熱安定性が変化することがあります。そこで結晶化したいタンパク質が最も安定なバッファー条件や添加剤を検討することは結晶化の成功にとってとても重要になります。さらにタンパク質が最安定なバッファーを見つけることはタンパク質の精製時に使用するバッファーの最適化にも貢献できるため、タンパク質精製の効率化にもつながります。
タンパク質の熱安定性を測定する方法にはさまざまな方法がありますが、微量かつハイスループットな方法であるサーマルシフトアッセイ法を採用しています。ただし、サーマルシフトアッセイ法で熱安定性が向上したように見える添加剤がタンパク質の凝集を引き起こすことがあるため、後述の動的光散乱法を用いたチェックは欠かせません。
図3にpH6.0-8.5の間で熱安定性が20℃近く変化したタンパク質のデータを示します。このタンパク質はpHと高次構造形成が連動しており、後段で説明するMulti-Detector SECのデータと組み合わせて、最も高次構造が安定なpHを見出すことに成功しました。
JAXAではタンパク質のサーマルシフトアッセイ用の解析プログラムが利用できるApplied BiosystemsのStepOnePlusを使用しています。
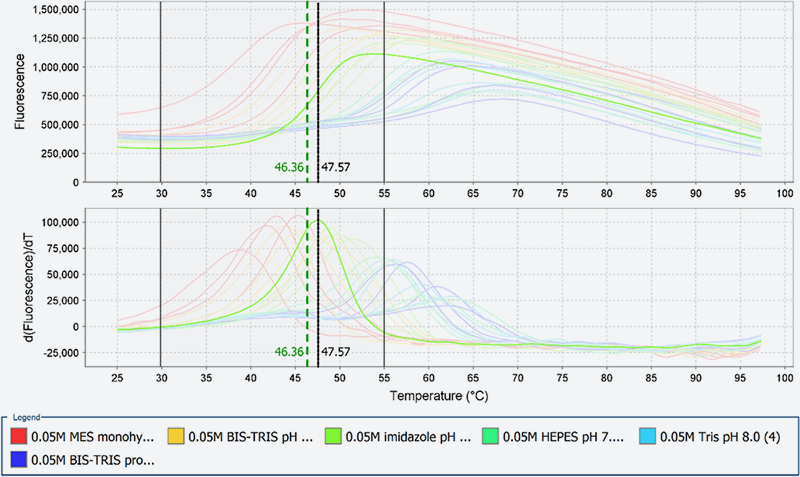
図3. 創薬標的蛋白質PのTSAの結果
一般的に結晶化に供するタンパク質試料は凝集体を含むものよりも、均一な粒子として溶液に分散している方が、結晶化しやすいことが知られております。これらの状態を調べる際に動的光散乱法(DLS)を用います。凝集体が確認できない、かつ、不均一性(%Pd)が15-25%の範囲になっていることを結晶化のクライテリアとしています。またサーマルシフトアッセイ法で見出したバッファー条件や添加剤によって凝集が生じていないかチェックする際にも用います。
JAXAではタンパク質のDLS測定に特化したMalvern社製のゼータサイザーμVを使用しています。
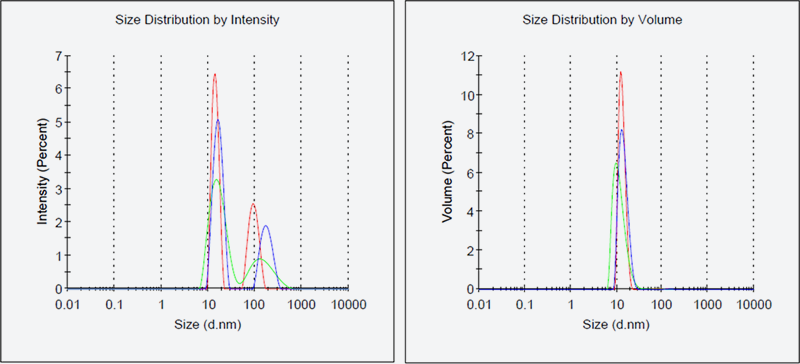
図4. 病原性微生物由来創薬標的蛋白質DのDLSの結果
図4の左側が散乱強度基準から計算した粒子サイズ分布、右側が体積基準で計算した粒子サイズ分布です。粒子のサイズが大きいほど散乱への寄与が大きいため、散乱強度基準では凝集体の存在が確認できますが、凝集体の量が極めて微量なため、右側の体積基準ではピークが確認できません。理想的には散乱強度基準で凝集体が認められない状態が望ましいのですが、目的のピークの不均一度が十分に小さい場合(%Pd<20)は体積基準で凝集体が確認できない状態であれば結晶化に着手します。
ゲルろ過カラムから溶出したタンパク質試料の屈折率、UV/Vis吸光度、光散乱を測定し、タンパク質の絶対分子量測定や4次構造形成状態の確認、凝集の評価等を行う手法です。
結晶化を行いたいタンパク質が溶液中で単量体なのか、オリゴマーになっているのかといった四次構造の評価や、ヘテロ複合体の形成確認などを行う際に用います。
JAXAではMalvern社製のマルチ検出器SECシステムであるOmniSECを使用しています。
図5にモノマー、2量体、3量体の存在比を検討した結果を示します。
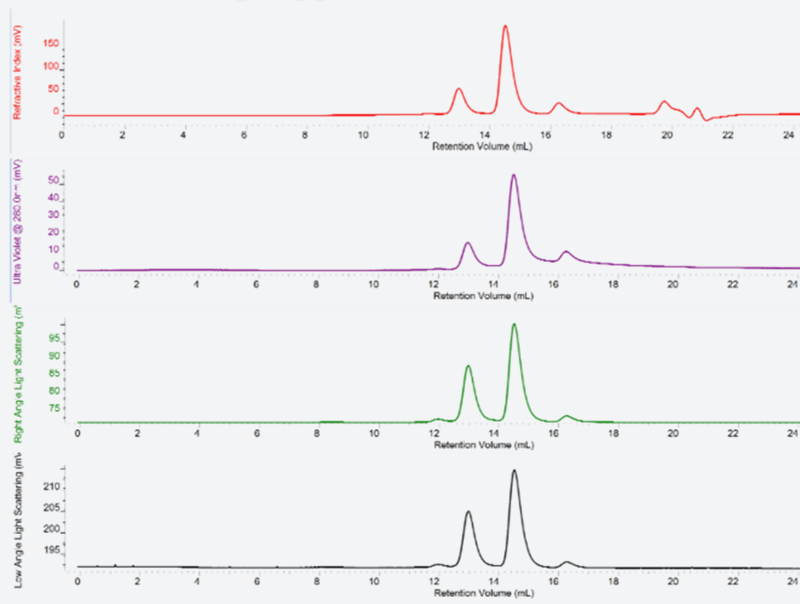
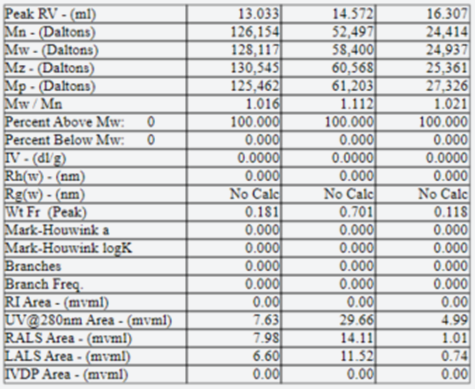
図5. 創薬標的蛋白質PのMulti-Detector SECの結果