
Result
02

キチンは、エビ・カニなどの甲殻類や昆虫類などの外骨格(殻)の主成分ですが、カビ・キノコなどの細胞壁などにも含まれており、強度成分としての機能を担う難分解性の高分子多糖です。その構造は、N-アセチルグルコサミン(アミノ糖の一種)が鎖状に数百から数千もつながった非常に長い構造をしています。甲殻類や昆虫類が属している節足動物は、地球最大の動物群であることから、キチンは植物細胞の細胞壁成分であるセルロースに次いで豊富に存在する生物資源であり、地球上で合成されるキチンの量は1年間で1,000億トンにもなると推計されています。
このように資源量の豊富なキチンは、生体適合性にも優れており、これまでに人工皮膚や手術糸として医療材料などに応用されてきました。しかしながら、キチンは難分解性の不溶性多糖で加工など取扱いが難しいことから、とても有効利用というレベルではありませんでした。その後、構成糖であるN-アセチルグルコサミンに変形性膝関節症の改善効果や美肌効果などが確認され、老化防止(アンチエイジング)対応の機能性食品として世界的に需要が高まったことから(商品名:グルコサミン)、その製造原料として有効利用されるようになりました。このように最近ではグルコサミンの製造原料としてのイメージが強くなったキチンですが、冷凍食品や缶詰製造など水産加工の際に多量に廃棄されるエビやカニの殻がキチンの製造原料として主に利用されています。
次にキチンを分解してグルコサミンを製造する方法についてですが、濃塩酸のような強酸によりキチンを加水分解する方法は製造コストが安いという利点はありますが、分解時に脱アセチル化が生じることで化学的に不安定になってしまいます。さらに、爽やかな甘味を有するN-アセチルグルコサミンとは対照的に、脱アセチル化したグルコサミンには独特の嫌な味があり、食品利用には適していません。このような理由から、N-アセチルグルコサミンの製造には酵素によるキチンの加水分解が適していますが、難分解性の不溶性キチンを直接分解できるパワフルな分解酵素がありませんでした。
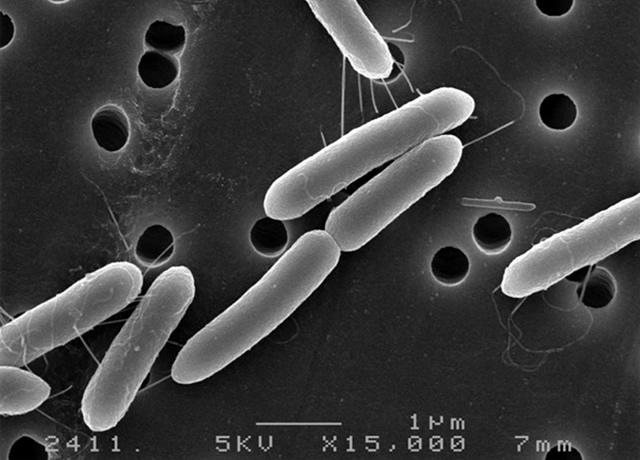
そこで私たちは、強力なキチン分解能力を持つ微生物を捕まえるために、福井県内の農地にキチンを大量に埋めるという罠を仕掛けました。この罠で多くのキチン分解微生物を捕獲できましたが、その中でも一番分解能力の高い微生物を分離してPaenibacillus sp. FPU-7株と命名しました。Paenibacillus属の細菌は自然界に広く分布していますが、驚くべきことにFPU-7株は不溶性のカニ殻キチンを直接分解することが可能であり、世界で初めてN-アセチルグルコサミン発酵生産技術の開発に成功しました(図1)。

図1. Paenibacillus sp. FPU-7株によるカニ殻キチンの分解
このように、FPU-7株のキチン分解機構は産業利用だけでなく学術的にも大変興味深いことから、キチン分解酵素の同定を行いました。FPU-7株の培養上清中には多数のキチン分解酵素(キチナーゼ)が分泌されていたため、ゲノム解析を行ったところ、合計12種類ものキチナーゼ遺伝子が同定されました(ChiA~ChiW)。さらに、不溶性のキチン分解にはChiWが中心的な役割を担っていることを明らかにし、本酵素はアミノ酸残基数が1,000を超える細菌由来としては巨大な酵素でした。また、一般的にキチナーゼは細胞外へ分泌される酵素ですが、ChiWは細胞表層に結合しており、キチンを分解する触媒ドメインを分子内に2つ有する極めて特徴的なキチナーゼでした。そこで、さらなる高機能化を目的としてChiWの精密な分子構造を得るため、宇宙実験での結晶化に取り組むことにしました。
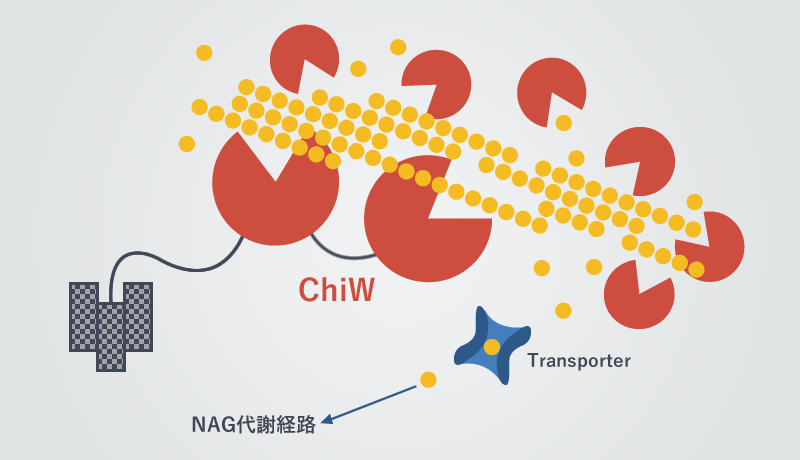
図2. FPU-7株は12種類のキチナーゼでキチンを分解!
ChiWは6個のドメインからなる分子量15万の巨大なタンパク質です (S層結合ドメイン (SLH)、CBM54糖質結合モジュール、イムノグロブリン様ドメイン-1、GH18触媒ドメイン-1、イムノグロブリン様ドメイン-2、GH18触媒ドメイン-2)。結晶化用のタンパク質試料として、SLHを除いたタンパク質 (ChiW-SLHD、分子量13万) と、ChiW-SLHDからさらにCBM54を除いたタンパク質 (ChiW-CD、分子量9万) を準備しました。結晶化条件の探索を行ったところ、どちらのタンパク質試料もリン酸アンモニウム塩とクエン酸緩衝液 (pH 5.5) を含む条件で結晶が得られました。ChiW-CDの結晶の方は2.0 A程度と比較的良い分解能を与えましたが、ChiW-SLHDの結晶 (図3) の方は2.9 A程度でした。
そこで分解能の向上を期待して、第一期「きぼう」利用高品質タンパク質結晶精製実験第5回実験搭載タンパク質に応募いたしました。第5回の宇宙実験では、期待通り、ChiW-SLHDの結晶の分解能は2.6 A程度にまで向上しました。ChiW-SLHDの結晶に関して、宇宙において核発生が起こりやすくなることがわかり、その後の分解能の向上に有用な知見が得られました。ChiW-CDの不活性な変異体に関しても結晶を得ることができ、キチンオリゴ糖 (5糖)との複合体に関して、2.6 A分解能で立体構造を決定できました。
続いて、第6回目、第二期第1、2回目と実験を行っていきました。その期間、タンパク質試料の精製用タグの位置をC末端からN末端に変更することや、N末端の配列を変更することなどを行ったところ、結晶の質が改善されていきました。さらに結晶化条件のいろいろな試行錯誤と宇宙実験によって、ChiW-SLHDの結晶の分解能は2.1 Aに到達しました (図4)。

図3. 宇宙実験開始時のChiW-SLHD結晶

図4. 微小重力下での結晶化条件が最適化されたChiW-SLHD結晶
そして、ChiW-SLHDの立体構造をChiW-CDを鋳型にした分子置換によって決定することができました (図5)。決定したChiW-SLHDの立体構造から、2つのGH18触媒ドメインを含む5つ(SLHを含めると6つ)のドメインからなる複雑なマルチドメイン構造で本酵素は出来ていることが明らかになり、β-ヘリクス構造と触媒ドメインをつなぐ、長さ35 Aのグリシンリッチなフレキシブルループの構造まではっきりと捉えることができました。今回明らかにした立体構造は、ChiWが特徴的な各ドメインを巧みに利用することによって、堅固な細胞壁キチンを効率よく分解できることを示していました (Itoh et al., PLos One. 11, e0167310, 2016)。
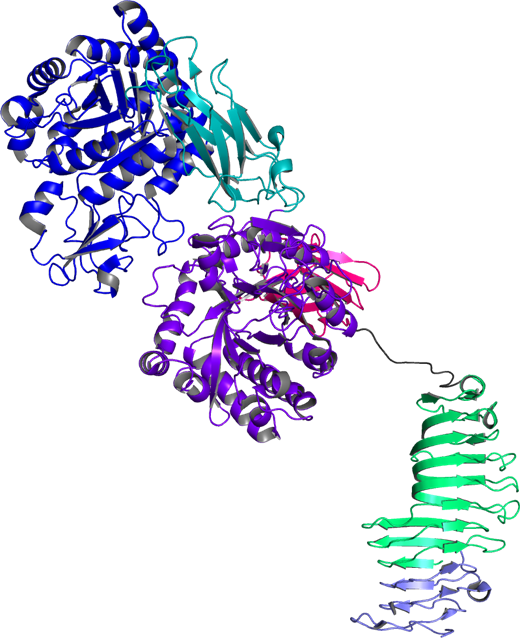
図5. ChiW-SLHD の2.1 A分解能結晶構造
私たちはキチンの構成糖(単糖)であるN-アセチルグルコサミン発酵生産技術の開発に成功しましたが、今後はキチンのオリゴ糖生産技術の開発を行いたいと考えています。キチンのオリゴ糖は、動植物の自然免疫系を活性化して生体防御反応を惹起するエリシター活性と呼ばれる機能が注目されています。実際に"ヒトや動物に対する抗腫瘍活性"や"植物の耐病性向上活性"が確認され大きな関心を集めています。
また、最近では植物や土壌により良い生理状態をもたらすような天然物質がヨーロッパを中心に世界中で注目されており、バイオスティミュラントと総称されています。キチンオリゴ糖のようなバイオスティミュラントは、植物が本来もっている自然な力を活性化させることにより、農作物の病害耐性や環境ストレス耐性、肥料の利用効率、収穫量、品質、品質保持期間などの向上が期待されます。
しかしながら、キチンのオリゴ糖は、酵素分解でも、酸分解でも生産効率が低く、効率の高い生産技術の開発が求められています。私たちが発見したChiWは、加水分解活性だけでなく、糖転移活性によるキチンの合成活性も有しており、今後はこの活性を利用してキチンオリゴ糖製造技術を開発したいと考えています。
